Этот сайт устарел - все новые материалы публикуются тут:
http://adopt-zu.soroka.org.ua/index.html
Здравствуте!
Я решился написать эту статью с целью собрать в одном месте ранее написанные мои статьи об особенностях использования свинцовых аккумуляторов, и развенчанию особенно вредных мифов об их использовании и восстановлении.
Статья написана на основании собственных исследований как литературы так и отдельных тестовых ячеек в хим.лаборатории.
Я повторял и повторяю еще раз: свинцовый аккумулятор мало чем изменился за последние 100лет, он постоянно подвергается варварскому отношению со стороны "потребителей", которое с успехом выдерживает  потому что обладает практически идеальной хим. схемой. Но об этом ниже...
потому что обладает практически идеальной хим. схемой. Но об этом ниже...
Итак, как это ни банально но начнем с азов.
Примерно в 1859-1860 годах в лаборатории Александра Беккереля, работал в качестве ассистента Гастон Планте. Молодой человек решил заняться улучшением вторичных элементов, чтобы сделать их надежными источниками тока для телеграфии. Сначала он заменил платиновые электроды "газового элемента" Грове свинцовыми. А после многочисленных экспериментов и поисков вообще перешел к двум тонким свинцовым пластинкам. Он их проложил суконкой и навил этот сэндвич на деревянную палочку, чтобы он влезал в круглую стеклянную банку с электролитом. Далее подключил обе пластины к батарее. Через некоторое время вторичный элемент зарядился и сам оказался способен давать достаточно ощутимый постоянной ток. При этом, если его сразу не разряжали, способность сохранять электродвижущую силу оставалась в нем на довольно продолжительное время. Это было настоящее рождение накопителя электрической энергии, или аккумулятора.
Самое интересное, что до сих пор самые мощные(по отдаваемому току и принимаемому току зарядки) свинцовые аккумуляторы это аккумуляторы фирмы "Оптима", и построены они тоже по "спиральному" принципу! ...история до сих пор ничему не учит остальных производителей 
Потом было обнаружено, что если заряженный первоначально прибор(см. рис выше) разрядить, затем пропустить через него ток в обратном направлении, да еще проделать эту операцию не один раз, то увеличивается слой окисла на электродах и емкость вторичного элемента возрастает. Этот процесс получил название формовки пластин и занимал у изобретателя Камилла Фора около трех месяцев.
После Парижской выставки 1878 года Фору пришла идея нового метода формовки пластин. Он попробовал заранее покрывать их оксидом свинца, свинцовым суриком. При зарядке сурик на одной из пластин превращался в перекись, а на другой соответственно раскислялся. При этом слой окисла приобретал очень пористое строение, а значит, площадь его поверхности существенно увеличивалась. Процесс формовки проходил значительно быстрее. Аккумуляторы Фора при том же весе запасали значительно больше электрической энергии, чем аккумуляторы Планте. Другими словами, их энергоемкость была выше. Это обстоятельство привлекло к ним большое внимание электротехников.
Технология "намазных пластин" современных аккумуляторов даже сейчас, спустя более 100 лет, остается такой-же...  Кто не верит - читаем книгу: М. А. Дасоян, В. В. Новодережкин, Ф. Ф. Томашевский "ПРОИЗВОДСТВО ЭЛЕКТРИЧЕСКИХ АККУМУЛЯТОРОВ"
Кто не верит - читаем книгу: М. А. Дасоян, В. В. Новодережкин, Ф. Ф. Томашевский "ПРОИЗВОДСТВО ЭЛЕКТРИЧЕСКИХ АККУМУЛЯТОРОВ"
Немного химии.
С точки зрения хим. динамики свинцовый аккумулятор(далее СА) представляет обратимую систему, и именно обратимый гидроэлектрический элемент. Восстановление свободной энергии такого элемента выражается накоплением на электродах продуктов электролитического распада. В теории гальванических элементов такое накопление, вторичный эффект эл.-хим. процесса, носит название поляризации. Вредное в обычных элементах, это побочное явление положено в основу службы СА, называемых поэтому вторичными, или поляризационными, элементами. В принципе, всякий СА состоит из одного электролита, содержащегося в некотором баке, и двух электродов с клеммами. Положительный электрод называется анодом, отрицательный—катодом (в американской литературе катод — положительная пластина, анод — отрицательная). Аккумуляторы различаются между собою химической природой электролита и электродов, формой и строением электродов, устройством бака и т. д.
Описание физ.-хим. процессов в СА
Разрядка и зарядка СА. характеризуются графиком, при чем как разрядная, так и зарядная кривые претерпевают три последовательные стадии
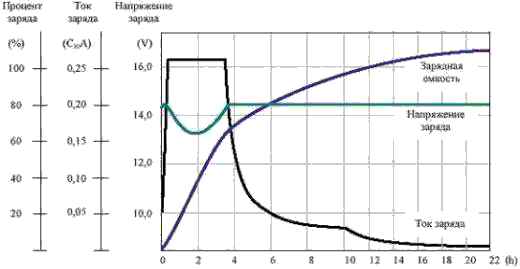
Рекомендуемый График заряда батареи после глубокого разряда.
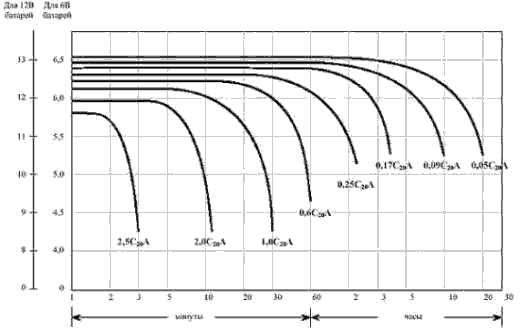
Графики разрядных характеристик при различных скоростях разряда
Стадия I: Занимает короткое время.
Зарядка: Сначала разность потенциалов быстро поднимается над значением 2V, соответствующим плотности электролита, а затем падает до 2,1V.
Разрядка: разность потенциалов очень быстро падает до 1,9 V.
Стадия II: Занимает наибольшую часть.
Зарядка: Разность потенциалов медленно возрастает, приблизительно до 2,2V.
Разрядка: Разность потенциалов медленно убывает, приблизительно до 1,85V.
Cтадия III: Занимает сравнительно небольшое время.
Зарядка: Разность потенциалов довольно быстро возрастает до 2,5—2,6V.
Разрядка: Разность потенциалов быстро падает, при чем кривая претерпевает изгиб и стремится к нулю (см. выше графики разряда - зависит от тока разряда!)
Этим трем стадиям соответствуют характерные видимые явления: в заряженном СА. катод имеет серо-металлический вид и состоит из губчатого свинца,тогда как анод покрыт перекисью свинца Pb2O5 интенсивного черного цвета, нестойким, сильно окисляющим веществом с значительной электропроводностью. Внезапное понижение стадии I разрядки происходит от уменьшения концентрации кислоты в порах активной массы СА, после чего концентрация выравнивается диффузией частиц кислоты в электролите.
Это очень важный момент, который надо понимать - из-за того что в СА применяется жидкий электролит, и толщина "намазки" пластин существенна, самым идеальным способом зарядки(да и разрядки!) СА была-бы пульсирующая зарядка, т.е. с применением ШИМ, а лучше "медленно-пульсирующего" типа - когда за плавным нарастанием импульса следует пауза, в течении которой происходит "усвоение" порции энергии(идут.хим процессы) и выравнивается плотность электролита(т.е. подается к материалу пластин новая порция серной кислоты из раствора).
Аналогично и для разрядки - мы знаем что если "дать отдохнуть" СА (сняв с него всю нагрузку) то напряжение на СА повышается и с него можно еще получить энергии. Обьяснение аналогичное: выравнивание плотности электролита, т.е. подача кислоты к материалу пластин за счет диффузии.
Стадия III разрядки связана со вторичным уменьшением концентрации кислоты. В разряженном CА. анод состоит из двуокиси свинца РЬО2, вещества бурого цвета, с удельным сопротивлением в 22 раза большим, чем у перекиси свинца Pb2O5. Катод состоит из недокисного сернокислого свинца Pb2SO4, вещества темносерого, почти черного цвета, обладающего значительною электропроводностью и весьма нестойкого механически (именно поэтому не рекомендуют трясти сильно разряженный АКБ!). Удельный вес электролита падает от уменьшения концентрации кислоты как раз в количестве, потребном для образования на катоде недокисной сернокислой соли. Именно поэтому, оставленный в бездействии незаряженный СА. гибнет («сульфируется», «сульфатируется»), при чем и катод и анод покрываются окисным сернокислым свинцом PbSO4, веществом белого цвета, НЕэлектронпроводным(!), стойким и стремящимся образовывать крупные кристаллы..
Если оставить батарею в разряженном состоянии, сульфат свинца начинает растворяться в электролите до его полного насыщения, а затем выпадает назад на поверхность пластин, но уже в виде крупных и практически нерастворимых кристаллов. Они откладываются на поверхности пластин и в порах активной массы, образуя сплошной слой, который изолирует пластины от электролита, препятствуя его проникновению вглубь. В результате большие объемы активной массы оказываются "выключенными", а общая емкость батареи значительно уменьшается.
Почему батарея из нескольких АКБ выходит из строя и неравномерно заряжается ?
Смотрим картинку:
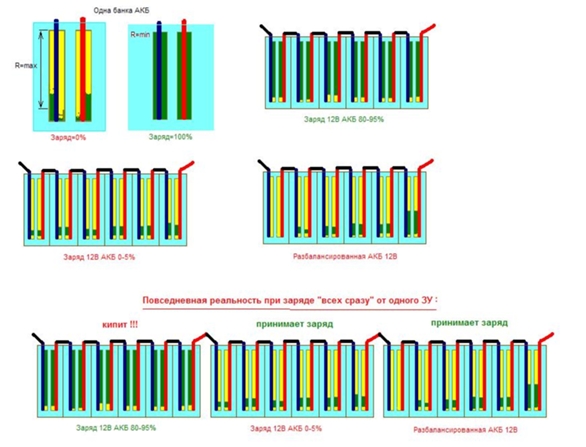
Это то что происходит внутри АКБ...
желтым - выделены "разряженные намазки". Зеленым - заряженные, в которых все вещества прореагировали.
Смотрите и думайте!
Ход реакций, по классческому учебнику" таков:
на катоде. . . . Pb+H2SO4+O ->PbS04+H20 I
на аноде . . Pb2SO4+H2SO4+O -> 2PbSO4+H2O II
Это и есть процесс сульфации или сульфатации, разрушающий электроды оставленного незаряженным СА. 
Но.... "Теория двойной сульфатации" говорите ? 
ну так вот еще пара кусочков "старого знания" - все эти реакции
(в том числе 20(!) неэлектродных, которым не нужна кислота!), протекают внутри Свинцового Аккумулятора,
и каждая из них вносит свою лепту в процессы:
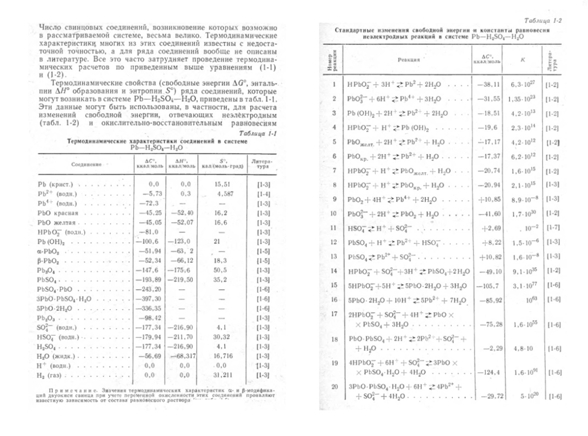

Кому верить ? 
....мои опыты и построенные на их базе "Умные зарядки" представленные на этом сайте, говорят о том что надо верить этим двум картинкам...
Существенное влияние па электрические характеристики положительного электрода свинцового аккумулятора оказывает фазовый состав двуокиси свинца.
Явление полиморфизма двуокиси свинца было впервые обнаружено советскими учеными еще в 50-х годах 20-го века. Было установлено, что, кроме ранее известной тетраrональной формы РbО2, а именно бетта-PbО2, существует ее ромбическая разновидность альфа-PbО2.
В результате многочисленных исследований в СССР было установлено, что емкость(запасенные Ампер*часы) бетта-РbО2 существенно превосходит емкость альфа-РbО2. (смотрим две картинки ниже)
Но при этом отношение емкостей бета-PbО2 к альфа-РbО2 почти не изменяется с изменением плотности разрядноrо тока.
Истинная поверхность порошкообразной бетта-PbО2 составляет 9.53, а альфа-РbО2 - лишь 0.48 м2/г. Все "классические зарядные устройства формируют в конце заряда АКБ(т.е.на поверхности намазок) преимущественно альфа-модификацию PbO2, потому что снижают ток заряда до минимальных величин, что приводит, исходя из описанного выше, к негативному влиянию на способность свинцового АКБ отдавать значительные токи в течении длительного времени!
Практическими исследованиями установлено, что образование двуокиси свинца памазок пластин при заряде АКБ начинается на поверхности раздела решетка - активная масса, постепенно распростриняясь к наружной поверхности пластины. При этом альфа-модификация РbО2 находится, в основном, в центре пластины, а бетта-модификация PbО2 в наружных частях активной массы. Разряд положительных пластин начинается с поверхности и распространяется вглубь параллельно поверхности. Значительная часть альфа-РbO2 при этом остается неразряженной, что мы и видим, резко снимая напряжение нагрузки с АКБ - напряжение на клеммах АКБ при этом резко растет, что говорит о большом резерве неразряженных слоев намазок содержащих альфа-РbO2.
Разрядная кривая положительноrо электрода характеризуется наличием минимума на начальном участке, что обусловлено значительным пересыщением раствора сульфатом свинца до начала ero кристаллизации. Так, первые кристаллы PbSО4 начинают появляться только через несколько минут после включения разрядноrо тока (при разряде малыми токами). Кристаллы сульфатов растут затем в направлении, параллельном и перпендикулярном поверхности пластины.
В электролите слабой концентрации альфа-РbО2 покрывается плотной пленкой сульфата свинца, в то время как на бетта-Pb02 сплошной изолирующей пленки не образуется. Это различие обусловлено различным механизмом разряда кристаллических модификаций двуокиси свинца.
Исследование поверхности электродов из двуокиси свинца под электронным микроскопом (см.картинку выше) после восстановления, показало что при любых условиях разряда сульфат свинца на альфа-РbО2 кристаллизуется в виде более тонкого и плотного(мелкодисперсного) слоя чем на бетта-PbО2.
Образование изолирующего слоя PbS04 на альфа-РbО2 затрудняет диффузию электролита под пленку сульфата, а значит и затрудняет
разряд более rлубоких слоев намазок АКБ.
Этот факт подтверждается характером изменения фазовоrо состава смеси альфа- и бетта- РbО2 в процессе разряда. Так, практическими исследованиями было доказано, что в процессе 20-часовоrо разряда АКБ количество бетта-PbО2 убывает с большей скоростью, чем количестно альфа-РbО2. Это различие обьясняется тем, что альфа-РbО2 локализуется в rлубине активной массы в виде отдельных мелких частиц и скорость ее разряда замедляется из-за недостатка электролита. При больших токах разряда ситуация усугубляется - АКБ резко снижает напряжение по этой-же причине. Эти "провалы" при больших токах сильно разлячны по величине у разного типа АКб - так у стартерных АКБ провал меньше из-за конструктивных особенностей - у них тонкие пластины и следовательно бОльшая доступность веществ и поверхности электродов для реакций чем у "тяговых" АКБ, у которых толстые пластины с толстым слоем намазок. Поэтому тяговые АКБ не предназначены для использования на токах выше 0.1С, но проектирощики электротраспорта и УПС это не учитывают, проектируя УПС и Э.Т. на тяговых АКБ на токи в 0.8-1С и выше!
Саморазряд-же бетта-PbО2 протекает вдвое медленнее саморазряда альфа-РbО2. Это объясняет тот факт, что несухозаряженные батареи приобретают большую разрядную емкость, если их полностыо зарядить, оставить стоять без использования несколько дней, а затем подзарядить перед испытанием на разряд. При этом емкость АКБ увеличивается с увеличением времени хранения, что является следствием перехода альфа-РbО2 в PbSO4 и последующеrо превращения PbSО4 в бетта-PbO2 при подзаряде.
Идем дальше. При сульфатации(сильном разряде) концентрация кислоты падает далее. При зарядке СА с пластинами, не подвергшимися выпадению кристаллов, катод вновь принимает серо-металлический цвет, анод чернеет, а концентрация электролита повышается. Зарядные и разрядные кривые СА. не совпадают между собой, и площадь между ними выражает потерю энергии на цикл зарядки и разрядки. Однако совершенное смыкание кривых доказывает, что в СА не происходит побочных реакций и что его можно рассматривать как элемент с почти совершенной обратимостью!
Но не все так гладко, как пишет нам учебник...
С момента изобретения свинцового кислотного аккумулятора и разработки в 1882 г. английскими исследователями Gladstone и Tribe химической теории, описывающей токообразующие реакции, протекающие на электродах свинцового аккумулятора при его разряде и заряде, известной как теория "двойной сульфатации", и до настоящего времени предпринимались неоднократные попытки пересмотреть эту теорию, предложить иной механизм протекания реакций (см. выше таблички с 63 реакциями)
Причины такого положения заключаются в том, что, не взирая на общее признание исследователями теории "двойной сульфатации" наиболее точно теоретически описывающей термодинамические процессы в свинцовом аккумуляторе, до настоящего времени существуют противоречия в количественной оценке веществ, участвующих в токообразующих реакциях, оценке состава веществ, образующихся па положительном электроде при разряде аккумулятора, а также в описании механизма протекания реакций на электродах аккумулятора. По многим вопросам у исследователей отсутствует единая точка зрения. Отдельные вопросы теории аккумулятора вообще подробно образом не освещены.
Теорию свинцового аккумулятора нельзя считать завершенной.
Так, например, согласно теории "двойной сульфатации" продуктом токообразующей химической реакции при разряде аккумулятора на положительном электроде является нерастворимое химическое вещество PbSO4 , осаждаемое на поверхности активной массы в количествах, обеспечивающих отдачу аккумулятором номинальной емкости.
Авторы "Учебников" пишут, не моргнув глазом, о "двойной сульфатации", но при таком механизме протекания токообразующей реакции уже при разряде аккумулятора на 1А·ч емкости поверхность его положительных электродов должна быть покрыта не менее чем 2 монослоями сульфатов свинца PbSO4, размер кристаллов которых сопоставим с диаметром пор в активной массе!!!
В результате этого свободный доступ молекул кислоты из состава электролита через поры к активной массе положительного электрода
затруднится, в связи с чем химическая реакция разряда должна будет прекратиться, чего на самом деле не происходит.
Полученная при расчётах интенсивность сульфатации электродов свинцового аккумулятора при его разряде на величину номинальной емкости оказалась слишком высокой, составляет десятки и сотни монослоев, что свидетельствует о том, что поверхностный процесс зарядообразования, протекающий согласно общепринятой теории "двойной сульфатации", не обеспечивает фактическую ёмкость реального аккумулятора!
То есть: в случае протекания химических реакций при разряде в свинцовом аккумуляторе в соответствии с теорией "двойной сульфатации" при снижении емкости на величину, не более 1 – 2% от номинальной, происходил бы его полный разряд.
Таким образом, полученные результаты исследования элементного состава активной массы положительных электродов аккумулятора разными учеными ставят под сомнение справедливость предлагаемого теорией "двойной сульфатации" механизма протекания электродного процесса на положительном электроде при разряде аккумулятора.
Следовательно, теория "двойной сульфатации" не полностью объясняет протекание процессов зарядо- и токообразования, саморазряда в свинцовом кислотном аккумуляторе и требует уточнения.
...................
И еще один больной вопрос: какова-же реальная "емкость отдаваемая" свинцовым АКБ?
Проверьте меня - вдруг я где-то ошибся...
Давайте проверим Википедию 
Мне надоело встречать везде разные цифры, а потом еще и читать про всякие "кривые индексы". Я решил взять калькулятор и посчитать...
1) Берем первый "доступный учебник" - Википедию:
http://ru.wikipedia.org/wiki/Свинцово-кислотный аккумулятор
...
# Удельная энергоемкость (Вт·ч/кг): около 30-40 Вт·ч/кг.
# Удельная энергоплотность (Вт·ч/дм?): около 60-75 Вт·ч/дм?.
2) Берем второй "доступный учебник":
http://www.felco.com.ua/index.php?infocategor y=akkum&infoname=capacity
"...
Для того, чтобы получить емкость величиной 1 Ач (по вышеуказанному), теоретически нужно 4,463 грамм двуокиси свинца, 3,886 грамм губчатого свинца и 3,66 грамм серной кислоты. Теоретический удельный расход активных масс электродов составляет 8,32 г/Ач. На самом деле в аккумуляторах удельный расход активных веществ при режиме разряда в 20 часов и температуре электролита 25 °С составляет от 15,0 до 18,5 г/Ач, что соответствует коэффициенту использования активных масс 45-55 %. ..."
 ...авторы похоже с калькулятором не дружат совсем: 4.463+3.886+3.66=12.09 грамм
...авторы похоже с калькулятором не дружат совсем: 4.463+3.886+3.66=12.09 грамм
Замечу что "3.66г кислоты" это 100% кислота, а у нас 1.23-1.27 плотность используется... 
Ладно - не верим своим глазам - берем 15грамм на 1 Ач.
15грамм = 1Ач
при 10 час.разряде ток = 0.1С (0.1Ампера)
Мощность: 0.1А*2В*10час=2ВА. при 100% активной нагрузки(cosФ=1) можно принять что ВА=Вт.
Если принять что у нас правильная тонкая стартерная намазка,
то мощность отдаваемая за 1 час будет такая: 1А*2В*1час=2Вт.
Плотность свинца примерно 9.6грамм на 1см3, но у нас "смесь",
так что возьмем среднюю плотность 9грамм на 1см3.
Тогда наши 15грамм=1Ач займут обьем всего 1.66см3. (напомню: 1дм3=1000см3=1литр)
то есть: требуемая толщина намазки всего доли миллиметра !!!
Считаем "удельную мощность", веря Авторам "учебника 2":
2Вт / 0.015кг = 133 Вт*ч/кг - это удельная энергоемкость реакции с учетом Кисп активных масс = 45%.
2Вт / 0.0016л = 1250 Вт*ч/литр - это удельная энергоплотность реакции с учетом Кисп активных масс = 45%.
Смотрим в "учебник 1" ... 
Кто и где нам врет ??? 
............................................
Немного "старого знания"...
...мало кто знает что в АКБ присутствует "альфа" и "бета" версия оксидов свинца. На самом деле они имеют сильно разные для эксплуатации свойства.
Так, например, бета-модификация кристаллов оксида свинца имеет в два раза большую энергоемкость при том-же количестве кислоты внутри АКБ.
Чудо ?  нет - смотрим кривые реальных опытов(ниже).
нет - смотрим кривые реальных опытов(ниже).

http://imageshack.us/photo/my-images/684/alfabetapbo22.jpg/
а вот что видно под микроскопом - это альфа- и бета- модификации.
Как явно видно - у бета- модификации кристаллы крупнее и пор для доступа кислоты больше, следовательно они могут отдавать более быстро энергию.

http://imageshack.us/f/684/alfabetapbo22.jpg/
...................
Теперь давайте поговорим немного о доставшей уже всех теме "ШИМ большими токами разрушает свинцовую АКБ" 
Согласно исследованиям Battery Council Internation al, 84% свинцово-кислотных батарей выходят из строя из-за сульфатации. Сульфатация является еще более остной проблемой в солнечных энергосистемах, потому что вероятность полного заряда в таких системах сильно отличается от традиционного заряда АБ. Увеличенные периоды недозаряда АБ в солнечных энергосистемах приводят к коррозии решетки, а положительные пластины аккумуляторов покрываются кристалами сульфатов.
Широтно-импульсная модуляция тока заряда может предотвратить образование отложений сульфатов, помогает преодолеть резистивный барьер на поверхности электродной сетки и пробить коррозию на переходах. В дополнение к улучшенному КПД заряда и увеличенной емкости, существуют убедительные доказательства того, что такой режим заряда может восстановить емкость АБ, которая "потерялась" со временем при работе АБ в фотоэлектрической системе. Некоторые результаты исследований приведены ниже.
В 1994 CSIRO, ведущая исследовательская группа в Австралии [1], опубликовала статью, в которой указывается, что пульсирующий ток заряда "позволяет восстановить емкость элементов, работавших в циклическом режиме". Процесс сульфатации замедляется, а внутренние слои коррозии становятся тоньше и разделяются на "островки". Электрическое сопротивление уменьшается и емкость увеличивается. Вывод статьи в том, что пульсирующий ток заряда "может привести к восстановлению емкости аккумуляторной батареи."
Другая статья, опубликованная Sandia National Labs в 1996 году [2], приводит данные по тестирования герметичных аккумуляторов, которые потеряли более 20% своей емкости. Обычный заряд постоянным током не мог восстановить потерянную емкость АБ. Затем батарея была заряжена с использованием ШИМ контроллера, что привело к "восстановлению большей части потерянной емкости АБ."
Наконец, Morningstar, провели тесты по восстановлению емкости АБ. Прилигаемый график [3] показывает, что аккумуляторная батарея восстановиля большую часть потерянной емкости после заряда при помощи SunLight контроллера. После теста, солнечная система освещения в течение 30 дней практически не обеспечивала освещение, так как система отключалась по защите от перезаряда каждую ночь. Аккумуляторная батарея была очень старой и подлежала утилизации. Затем, нагрузка стала работать дольше каждую ночь, что отражено на графике. В течение последующих 3 месяцев емкость АБ постоянно возрастала. Этот тест продолжается в Morningstar .
Позднее было проведено исследование контроллеров с ШИМ, которое доказало, что контроллеры повышали восприимчивость АБ к заряду именно вследствие использования широтно-импульсной модуляции тока заряда. Контроллеры MorningStar SunSaver позводили даже увеличить эффективность заряда АБ на 2-8% даже по сравнению с контроллерами, которые поддерживали постоянно высокое напряжение на АБ.
Литература:
1. Lam, L.T., et al, ‘Pulsed-current charging of lead/acid batteries-a possible means for overcoming premature capacity loss?,’ CSIRO, Australia, Journal of Power Sources 53, 1995.
2. Hund, Tom, ‘Battery Testing for Photovoltai c Application s,’ Sandia National Laboratorie s, Albuquerque, NM, presented at 14th NREL Program Review, Nov. 1996.
3. Morningstar test results, 1999. http://www.morningstarcorp.com/en/support/library/8.%20Why%20PWM1.pdf (реальные тесты для особо неверующих 
Что здесь правда или похоже на правду ?
Правда то что пульсирующее напряжение заряда(разряда) очень хорошо ложится на химию процесов в СА - т.е. в паузах между импульсами идет диффузия электролита.
Неправда тут в том что не все АКБ удастся восстановить таким способом  старый анекдот про "поздно пить Боржоми когда почки отвалились"
старый анекдот про "поздно пить Боржоми когда почки отвалились"  т.е. если вы гоняете СА "от конца до конца" то вы тем самым расшатываете частицы намазных пластин, тем самым способствуете осыпанию состава пластин вниз банок
т.е. если вы гоняете СА "от конца до конца" то вы тем самым расшатываете частицы намазных пластин, тем самым способствуете осыпанию состава пластин вниз банок  Это характерно для "наливных" СА - т.е. "стартерного типа" , где сепаратор, как и 100лет назад, состоит из простых пластин с дырочками погруженных в кислоту
Это характерно для "наливных" СА - т.е. "стартерного типа" , где сепаратор, как и 100лет назад, состоит из простых пластин с дырочками погруженных в кислоту  . В аккумуляторах AGM технологии осыпания пластин нет, потому что они жестко схвачены стекломатами. Следовательно, при бережном обращении, СА AGM типа могут эксплуатироваться во много раз дольше чем СА со "свободным"(плещущимся) электролитом. Но это при условии НЕДОПУЩЕНИЯ сульфатации!!!
. В аккумуляторах AGM технологии осыпания пластин нет, потому что они жестко схвачены стекломатами. Следовательно, при бережном обращении, СА AGM типа могут эксплуатироваться во много раз дольше чем СА со "свободным"(плещущимся) электролитом. Но это при условии НЕДОПУЩЕНИЯ сульфатации!!!
Про аккумуляторы AGM технологии я писал вот тут:
http://electrotransport.ru/ussr/index.php/topic,1950.0.html
Восстановление "УПСовых" аккумуляторов - смотрите там-же.
Есть для электромобилистов еще одна хорошая новость - компания Варта начала выпуск стартерных СА по технологии AGM емкостью до 100Ач:
http://www.bat.by/product.php?id=84
и вместе с этой новостью мы подошли к еще одному важному вопросу:
Есть-ли разница в применении для электротранспорта "стартерных" и "тяговых" СА?
Производители СА нам врут  Ведь по идее эти СА должны чем-то отличаться, но на практике, мне лично пришлось позаглядывать внутрь разных СА разных предназначений от разных производителей - так вот - обещанное правило "у тяговых СА пластины толще" не работает
Ведь по идее эти СА должны чем-то отличаться, но на практике, мне лично пришлось позаглядывать внутрь разных СА разных предназначений от разных производителей - так вот - обещанное правило "у тяговых СА пластины толще" не работает 
Внесем ясность: с точки зрения Химии процессов, вы НИГДЕ в литературе не увидите разных характеристик - т.е. отдельно для тяговых и отдельно для стартерных. Химия-то внутри одна! В чем-же разница ? в том что (по науке) стартерные СА должны разрабатываться с учетом отдачи больших токов (сотни ампер), а тяговые нет - они должны отрабатывать меньшие токи но более длительный период.
И вот тут-то и начинается "минное поле вранья"... Рассмотрим плюсы и минусы.
Более толстая намазка при тех-же токосьемных электродах, дает бОльшую емкость СА. Но при этом у СА "свободного электролита" способствует большему разрушению намазки пластин  из-за того что технология по прежнему 100 лет не меняется
из-за того что технология по прежнему 100 лет не меняется  - вся активная паста держится только за счет своих свойств как "застывшей замазки". Читаем книгу М. А. Дасоян, В. В. Новодережкин, Ф. Ф. Томашевский - ПРОИЗВОДСТВО ЭЛЕКТРИЧЕСКИХ АККУМУЛЯТОРОВ и плачем...
- вся активная паста держится только за счет своих свойств как "застывшей замазки". Читаем книгу М. А. Дасоян, В. В. Новодережкин, Ф. Ф. Томашевский - ПРОИЗВОДСТВО ЭЛЕКТРИЧЕСКИХ АККУМУЛЯТОРОВ и плачем...
Более толстая намазка также способствует более длительному времени "отдыха" СА, так как в толстых массах пластин процессы диффузии идут медленнее 
Более тонкая намазка при тех-же токосьемных электродах, дает бОльшую способность отдачи токов от СА. При этом гораздо меньше время "отдыха" (диффузия лучше) и гораздо более доступны хим.элементы пластин - я видел "польские нонейм" АКБ у которых количество пластин было раза в полтора больше и они были тоньше чем у подобных-же стартерных - так вот "ударный разряд" они держали гораздо лучше чем "классика".
...самое интересное что если заклеить все надписи в СА и дать вам фонарик заглянуть в банку СА - то вы в 80% случаев не сможете отличить стартерные СА от тяговых 
А давайте теперь все что я написал выше суммируем и попытаемся представить себе "идеальный СА" имеющий не ниже 3000 циклов  и быстро отдающий и быстро принимающий токи в сотни ампер, при этом имеющий отдачу энергии в 3-4 раза выше при том-же весе как аналогичный "классический стартерный". Фантастика ? НЕТ - это реальность!
и быстро отдающий и быстро принимающий токи в сотни ампер, при этом имеющий отдачу энергии в 3-4 раза выше при том-же весе как аналогичный "классический стартерный". Фантастика ? НЕТ - это реальность!
Что мешает долгой жизни СА ? Разрушение пластин-токоотводов(из-за изменения плотности намазки в процессе циклирования) плюс сульфатация.
Что мешает растворению "сульфат. слоя" ? низкая его электропроводимость...
Что даем нам до 70% лишнего веса СА? толстые токоо… Продолжение »